成都生物所王飛團隊在開發RNA結合蛋白TRBP抑制劑治療肝癌的研究中取得新進展
時間:2025-03-28
近日,中國科學院成都生物研究所國家天然藥物工程技術研究中心王飛研究員與盧曉霞研究員團隊在藥物化學國際頂級期刊Journal of Medicinal Chemistry上發表題為“Design, Synthesis, and Antitumor Activity Evaluation of 2?Phenylthiazole-5-Carboxylic Acid Derivatives Targeting Transactivation Response RNA-Binding Protein 2”的最新研究成果。該研究團隊設計合成了一種新型2-苯基噻唑-5-羧酸衍生物CIB-L43,該化合物通過靶向轉錄激活反應RNA結合蛋白2(transactivation response RNA-binding protein 2, TRBP)展現出顯著的抗肝細胞癌活性,為肝癌治療提供了新的臨床前候選藥物。
肝細胞癌(Hepatocellular carcinoma, HCC)是全球第六大高發癌癥和第三大癌癥致死原因,而臨床治療面臨嚴峻挑戰。手術切除后5年復發率高達70%,而現有靶向藥物如索拉非尼和侖伐替尼的中位總生存期僅6-12個月,且存在顯著的藥物耐受性和毒性問題。過去研究表明,miRNAs的種類和表達變化參與了肝癌發生的各個階段,也被作為生物標志物用于癌癥早期診斷、預測治療效果和確認進展風險。因此,通過化學小分子藥物調控肝癌細胞內miRNA的表達將為肝癌治療提供新的治療手段。近年來的研究表明,TRBP也是miRNA加工過程中的關鍵蛋白,它能提高Dicer?剪切pre-miRNA形成成熟miRNA的效率和精度,而TRBP的突變將導致miRNA的異常表達而誘發癌癥的發生。2022年,王飛和盧曉霞研究員團隊同樣發表在《Journal of Medicinal Chemistry》(2022, 65:11010-11033)的文章中曾報道過,基于表型的高通量篩選發現一個苯基噁唑類小分子CIB-3b可以通過破壞TRBP和Dicer的蛋白間相互作用,從而調控細胞內miRNA的生物合成,有效的抑制肝癌細胞在體外和體內的增殖與轉移。作為國際上首個報道的TRBP抑制劑,CIB-3b成藥性還存在一定的缺陷,例如體內容易被代謝等。
為了進一步提高苯基噁唑類先導化合物的成藥性,通過系統的結構優化策略:1)改造五元雜環電子密度;2)引入氫鍵供受體基團;3)優化苯環取代基,最終設計合成了64個衍生物。其中,42個衍生物顯示出優于先導化合物的miRNA生物合成抑制活性。通過構效關系研究,團隊確定了2-苯基-4-甲基噻唑-5-羧酸這一關鍵藥效團骨架,并進一步通過苯環4位疏水片段修飾和3,5位鹵素取代優化,成功獲得最優化合物CIB-L43。CIB-L43展現出納摩爾級的miR-21抑制活性(EC50 = 0.66 nM),強效TRBP結合親和力(KD = 4.78 nM)和顯著破壞TRBP-Dicer相互作用(IC50 = 2.34 μM)。機制研究表明,CIB-L43通過抑制致癌miR-21的生物合成,上調抑癌PTEN和Smad7的表達,進而阻斷AKT/mTOR和TGF-β/Smad信號通路,有效抑制HCC細胞的增殖和遷移。特別值得注意的是,CIB-L43展現出優異的成藥性:口服生物利用度達53.9%,體內抗腫瘤效果與一線抗癌藥物索拉非尼相當且毒性更低。本研究進一步證實靶向TRBP的小分子抑制劑在肝癌治療中的臨床應用潛力,為肝癌治療提供了極具前景的first-in-class臨床前候選藥物
王飛研究員、盧曉霞研究員為本論文共同通訊作者;成都生物所史海龍、余佳凌、李凌宇和姬明慧博士為本文并列第一作者。該研究得到了國家自然科學基金、中國科學院戰略生物資源計劃、中國科學院成都生物研究所攻關團隊項目等的支持。
原文鏈接:https://doi.org/10.1021/acs.jmedchem.4c02041
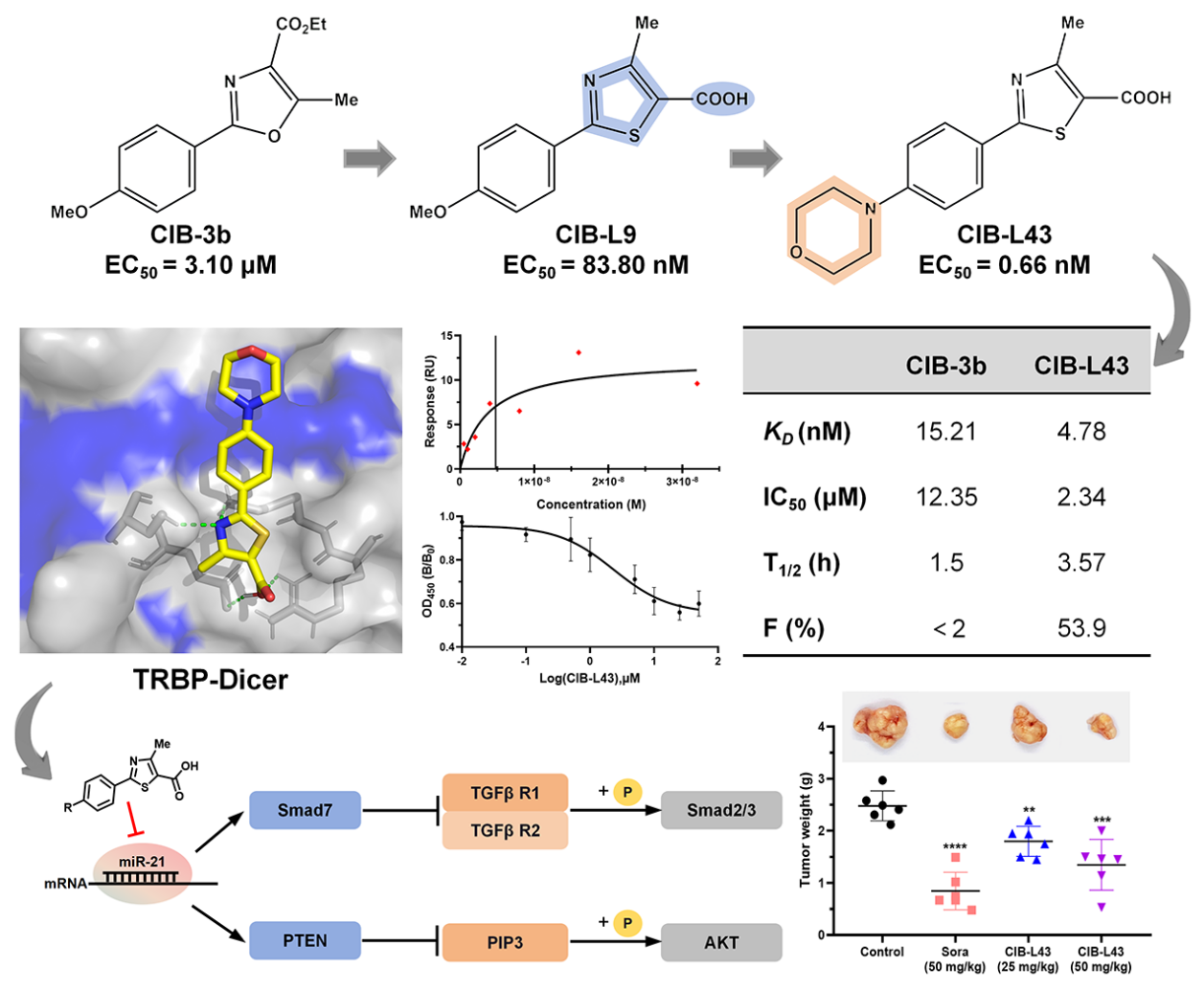
圖. CIB-L43的抗肝癌作用和機制摘要圖




